A todo medicamento é atribuído um prazo de validade (“ Conforme consta na Farmacopeia Brasileira, 5ª Edição – Volume 1, prazo de validade é o tempo durante o qual o produto poderá ser usado, caracterizado como período de vida útil e fundamentado nos estudos de estabilidade específicos, devendo ser indicado nas embalagens primárias e secundárias, entendendo-se como vencimento do prazo quando indicar mês e ano, o último dia do mês, sendo obrigatória a manutenção das condições especificadas pelo fabricante, de armazenamento e transporte, para preservação da integridade do produto” que vem acompanhado de sua embalagem primária lacrada e segundaria. Ao abrir a embalagem este produto passa a ter uma validade extemporânea de acordo com a bula do fabricante, pois com abertura ocorre exposição, manuseio, utilização e armazenamento.
Após aberto qualquer embalagem de medicamento ele perde a validade de fábrica, cujo o prazo pode variar de horas, dias ou até meses dependendo da sua composição química, sua forma farmacêutica se é sólida, líquida ou semissólida, além do seu processo de manipulação, embalagem, condições ambientais e armazenamento.
Recipientes para doses múltiplas são herméticos que permitir a retirada de doses sucessivas de seu conteúdo, sem alterar a sua concentração, pureza e a estabilidade da porção restante. Considera-se que a forma farmacêutica (se sólida, líquida ou semissólidas), após abertura da sua embalagem primária, está adquire características de um medicamento extemporâneo. Por isso após a abertura, o medicamento passará a ter uma data limite para o uso, que poderá variar entre horas, dias ou meses, que depende dá forma farmacêutica, do processo de manipulação, das condições de armazenamento (BRASIL, 2012).
Pensando nos colírios são acondicionados em embalagens de doses múltiplas que contém conservantes antimicrobianos que ajudam a inibir o crescimento de microrganismos. Alguns fabricantes costumam mensurar o prazo de validade após a abertura e a forma de armazenamento, pois foram realizados testes de estabilidade desses produtos.
Os medicamentos que passam por reconstituição antes da administração possuem prazos de validades diferentes, antes e após a reconstituição.
Assim como os colírios, as pomadas, as soluções orais gotas ou inalatórias apresentam um prazo de validade extemporânea de acordo com estudo de estabilidade realizado pelo fabricante (Cebrim 2005).
No caso das insulinas veem em frascos multidoses onde a maioria apresenta um prazo de validade após aberto de 28 (vinte e oito) dias sobre refrigeração (Tarr, Campbell.,Workman,1991).
Os medicamentos injetáveis apresentados em recipientes multidoses possuem uma rolha de borracha que permite o fechamento após a perfuração com a agulha. As rolhas de borracha possuem propriedades para permitir mais de uma perfuração desde que técnicas corretas de manuseio sejam aplicadas, entretanto a definição do prazo de validade após a primeira perfuração da embalagem é de difícil determinação e ainda é necessário verificar a presença de conservantes (Ebserh).
Assim, faz-se necessário estabelecer medidas de cuidados no manuseio dos produtos em recipientes multidoses para garantir a estabilidade dessas preparações. A estabilidade de um produto farmacêutico pode ser definida como a capacidade do produto de manter, dentro dos limites especificados, por todo o período de utilização, as mesmas propriedades e características que possuía no momento de sua fabricação (UNITED STATES PHARMACOPEIAL – USP, 1999).
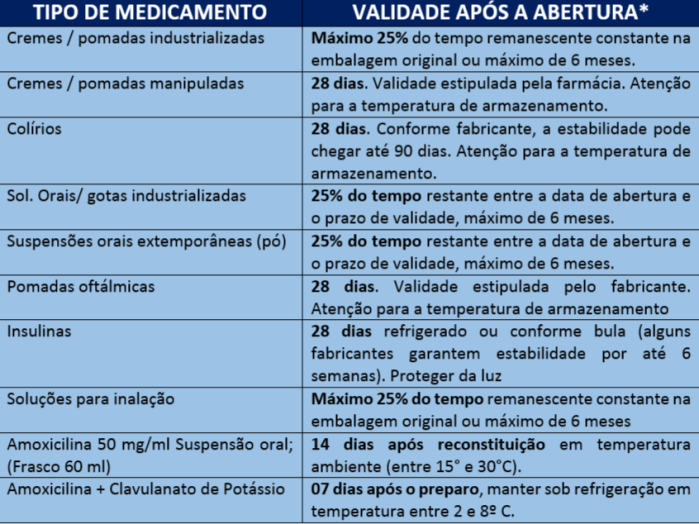
Legenda: *As recomendações podem ser alteradas de acordo com o fabricante.
EXEMPLO 1: Medicamento aberto em 01/2017, com validade até 01/2020: faltam 36 meses para vencer. Logo, 36/4 (25% do tempo) = 9 meses. Logo, consideraremos 6 meses, porque é o máximo de tempo que permitido após ruptura do lacre.
EXEMPLO 2: Medicamento aberto em 04/2017, com vencimento em 12/2018: faltam 20 meses para vencer: 20/4 (25% do tempo) = 5 meses. Logo, o prazo de validade será 09/2017.

Fonte:
http://www2.ebserh.gov.br/documents/147715/0/multidoses/f439fefa-c8a4-4434-b821-dc5e18417aa1
https://www.isgh.org.br/intranet/images/Servicos/Manuais/ISGH_FARMACIA_BOLETIM_02_020117_3.pdf







 Antibióticos tópicos também causam efeitos colaterais sérios uma equipe de médicos e cientistas lançou uma advertência sobre os efeitos colaterais do uso excessivo dos antibióticos tópicos. Foram analisados cerca de 6.500 casos em que antibióticos tópicos – na forma cremes, pomadas etc. – foram aplicados em feridas cirúrgicas para prevenir a infecção. “Descobrimos que, embora os antibióticos tópicos tenham-se mostrado moderadamente eficazes, seu uso não poderia ser justificado porque não havia informações suficientes sobre efeitos adversos, como resistência e alergia,” disse a Dra. Clare Heal, da Universidade James Cook (EUA). Os efeitos adversos dos antibióticos tópicos incluíram dermatite de contato alérgica, anafilaxia (reação alérgica grave e perigosa) e resistência a antibióticos. Particularmente as preocupações de que esses medicamentos também poderiam estar contribuindo para a resistência bacteriana aos antibióticos se confirmaram. “Os resultados deste estudo desencorajarão o uso excessivo de antibióticos tópicos pela comunidade cirúrgica e ajudarão a lutar contra a questão global da resistência aos antibióticos,” afirmou Heal. Fonte: British Journal of Surgery
Antibióticos tópicos também causam efeitos colaterais sérios uma equipe de médicos e cientistas lançou uma advertência sobre os efeitos colaterais do uso excessivo dos antibióticos tópicos. Foram analisados cerca de 6.500 casos em que antibióticos tópicos – na forma cremes, pomadas etc. – foram aplicados em feridas cirúrgicas para prevenir a infecção. “Descobrimos que, embora os antibióticos tópicos tenham-se mostrado moderadamente eficazes, seu uso não poderia ser justificado porque não havia informações suficientes sobre efeitos adversos, como resistência e alergia,” disse a Dra. Clare Heal, da Universidade James Cook (EUA). Os efeitos adversos dos antibióticos tópicos incluíram dermatite de contato alérgica, anafilaxia (reação alérgica grave e perigosa) e resistência a antibióticos. Particularmente as preocupações de que esses medicamentos também poderiam estar contribuindo para a resistência bacteriana aos antibióticos se confirmaram. “Os resultados deste estudo desencorajarão o uso excessivo de antibióticos tópicos pela comunidade cirúrgica e ajudarão a lutar contra a questão global da resistência aos antibióticos,” afirmou Heal. Fonte: British Journal of Surgery
 Descontinuação definitiva de Perlutan® Em Maio de 2018 comunicamos por aqui a descontinuação temporária do medicamento Perlutan® (algestona acetofenida + enantato de estradiol), por alterações no processo de fabricação do produto e consequente desabastecimento no mercado nacional, segundo informado pela Boehringer Ingelheim do Brasil. Em Setembro de 2018, a empresa supracitada disponibilizou novo comunicado em seu site informando, desta vez, a descontinuação definitiva de importação do Perlutan®, devido a razões comerciais. Já passaram-se alguns meses desde o referido comunicado, mas como a informação faltava por aqui, aproveitamos a oportunidade para posicionar o leitor. A Boehringer Ingelheim esclarece que as alternativas terapêuticas para o medicamento devem ser discutidas individualmente pelos pacientes junto a seus médicos. Fonte: boehringer-ingelheim.com.br
Descontinuação definitiva de Perlutan® Em Maio de 2018 comunicamos por aqui a descontinuação temporária do medicamento Perlutan® (algestona acetofenida + enantato de estradiol), por alterações no processo de fabricação do produto e consequente desabastecimento no mercado nacional, segundo informado pela Boehringer Ingelheim do Brasil. Em Setembro de 2018, a empresa supracitada disponibilizou novo comunicado em seu site informando, desta vez, a descontinuação definitiva de importação do Perlutan®, devido a razões comerciais. Já passaram-se alguns meses desde o referido comunicado, mas como a informação faltava por aqui, aproveitamos a oportunidade para posicionar o leitor. A Boehringer Ingelheim esclarece que as alternativas terapêuticas para o medicamento devem ser discutidas individualmente pelos pacientes junto a seus médicos. Fonte: boehringer-ingelheim.com.br
Você precisa fazer login para comentar.